Staff
| 助教授 | 北村 揚一 | 理学博士(京都大学) |
| 講師 | 渡部 清勝 | 理学博士(大阪大学) |
| 4回生 | 尾崎 太一 | 竹原高校(広島)卒 |
| 4回生 | 谷本 智哉 | 大手前高松高校(香川)卒 |
| 4回生 | 日野 梨紗 | 松山東高校(愛媛)卒 |
| 4回生 | 宮内 力 | 松山東高校(愛媛)卒 |
| 4回生 | 山口 朋弘 | 新田高校(愛媛)卒 |
研究内容
| 私たちはコバルト(Ⅲ)錯イオンの反応を研究しています。コバルト(Ⅲ)錯イオンは100年以上前に作られて、現在の錯体化学という広い分野の出発点になったものです。古いものではありますが錯体の基本を知るものとして今も尚、世界的に広く研究されています。ここ数年來、新しいコバルト錯体をかなり作りました。今は、それらの反応速度を測定しています。 |
| 現在対象とする反応は | |
| [Co(CO3) (L4)]n+ + 2H+ + H2O = [Co(L4) (H2O) 2]n+2 + CO2 | (1) |
| [Co(hfac) (L4)]n+ + OH- = [Co(hfacOH) (L4)]n-1 | (2) |
| L4 は残余4座を占める配位子。Hhfac = hexafluoro-2,4-pentanedione. |
| (1)は50年前から知られている反応ですが、ここ数年来、当研究室で提出した改良機構の 妥当性を確かめてきました。(2)は当研究室で20年前に見い出だされた反応です。昨年ある種のL4の場合に反応が2段階に進行する事がわかりました。今年は更に色々なL4の場合について研究しています。どちらの場合も錯イオンと酸または塩基を混合すると、数秒で反応は終了するのでストップドフローという方法で速さを測定します。 |
日本化学会第84春季年会(2004)
ヘキサフルオロー2,4-ペンタンジオナトコバルト(3)錯体の特異な酸塩基反応の速度論的研究
|
(愛媛大理)○北村揚一・佐々木洋一・伴野倫子・中江功・角本吉康
・田中裕士 Kinetic Study of the Unique Acid-Base Reaction of a Hexafluoro-2,4-pentanedionatocobalt(3) Complex (Ehime Univ., Faculty of Science) KITAMURA, Yoichi; SASAKI, Yoichi; BANNO, Michiko; NAKAE, Isawo; KAKUMOTO, Yoshiyasu; TANAKA, Hiroshi 15種の錯体について水中での表題反応の速度を、25℃イオン強度0.2(NaClO4, KNO3)でストップドフロー法により測定した。1) |
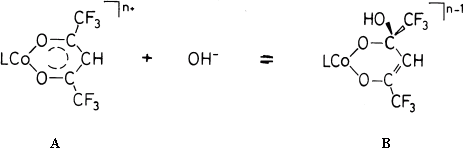
|
酸型Aの溶液と塩基性緩衝溶液(Tris-HClO4等)、又は塩基型Bの溶液と酸性緩衝溶液(MES-NaOH)を混合した後の吸光度(360 nm)の時間変化を追跡した。その結果を1次減衰曲線(kobs)、又はL = tren 等の場合には逐次1次減衰曲線(kfast, kslow)として解析した。ラピッドスキャンスペクトルを考慮すると後者の場合にはBの異性体の効果が現れていると考えられる。kobs及びkfast+ kslowはkOH[OH-] + kH[H+] + kH2O で表される。kOH = (0.01~3) 107 M-1s-1は正方向の反応、kH = (3~30) 107 M-1s-1はBとH+との反応、kH2O =2~34 s-1 は逆反応とAと水分子との反応の和に対応する。残余4座を占める配位子の混合Lの種類によるkOHとkHの値の変動は錯体電荷の効果と推定できる。 L = (NH3)4の場合に活性化パラメターはkOHについて90 kJ mol-1, 48 JK-1mol-1、kHについて14 kJ mol-1, -186 JK-1mol-1である。低い活性化エネルギー値から判断すると、後者は拡散律速過程である。 1) Y. Kitamura and A. Shibata, Polyhedron, 12, 2143-2151 (1993). |
日本化学会第83春季年会(2003)
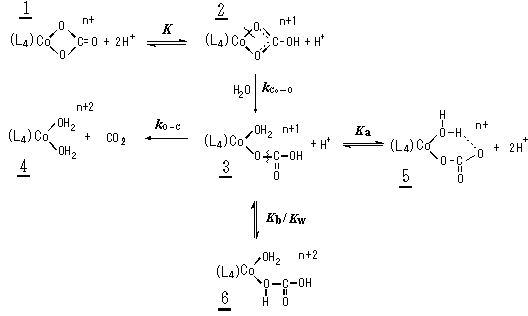
カルボナトコバルト(III)錯体の酸加水分解反応速度
|
(愛媛大理)北村 揚一 24種の錯体1について表題反応速度を15-45 ℃、酸濃度0.1-1.0 M、イオン強度2.0 で測定した。Kは1 M-1である。kCo-OはL4に依存して25 ℃で 0.006-126 s-1である。これはL4が形成する5員環キレートのストレスと電荷の効果で理解できる。kO-Cは25 ℃で 1 s-1である。KaはL4にやや依存して0.005-2 Mである。これは5における分子内水素結合に及ぼすトランス5員環キレートの効果で理解できる。Kb/KWは0.3 M-1である。 K, kO-C, Kb/KW がL4に依らない事はこれらの定数が配位子上での変化に対応する事で理解できる。 |
Outline of our investigation
| We study the reaction of cobalt(III) complex ions. Cobalt(III) complex was first prepared more than 100 years ago and it was an original compound for modern wide ranging field of coordination chemistry. Although known since long ago, it is still under world wide investigation as substance providing fundamental information of the coordination chemistry. Recently, we have prepared a lot of new cobalt complexes and are now studying the kinetics of such complex ions. We are now treating with following reactions. |
| [Co(CO3) (L4)]n+ + 2H+ + H2O = [Co(L4) (H2O) 2]n+2 + CO2 | (1) |
| [Co(hfac) (L4)]n+ + OH- = [Co(hfacOH) (L4)]n-1 | (2) |
| , where L4 stands for a mix of ligands occupying the residual four coordination sites of the metal center and Hhfac = hexafluoro-2,4-pentanedione. Reaction 1 was known for 50 years. We have proposed and confirmed our modified mechanism of this reaction. Reaction 2 was originally found in our labolatory 20 years ago. We have found last year that it proceeds as a two step reaction in the case of certain L4 and are now investigating it for further variation of L4. Reactions 1 and 2 finish within several seconds after the mix of complex solution with an acid or base. Therefore, we study the kinetics of these reactions using a stopped flow method. |